研究内容
ユビキチン修飾系
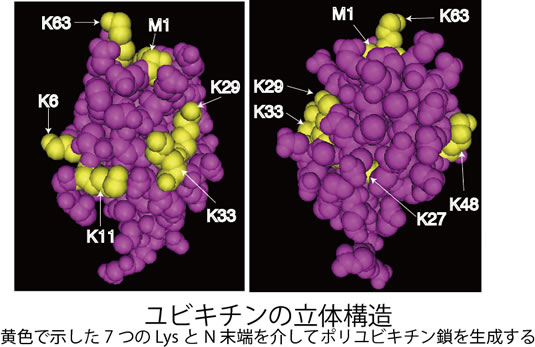
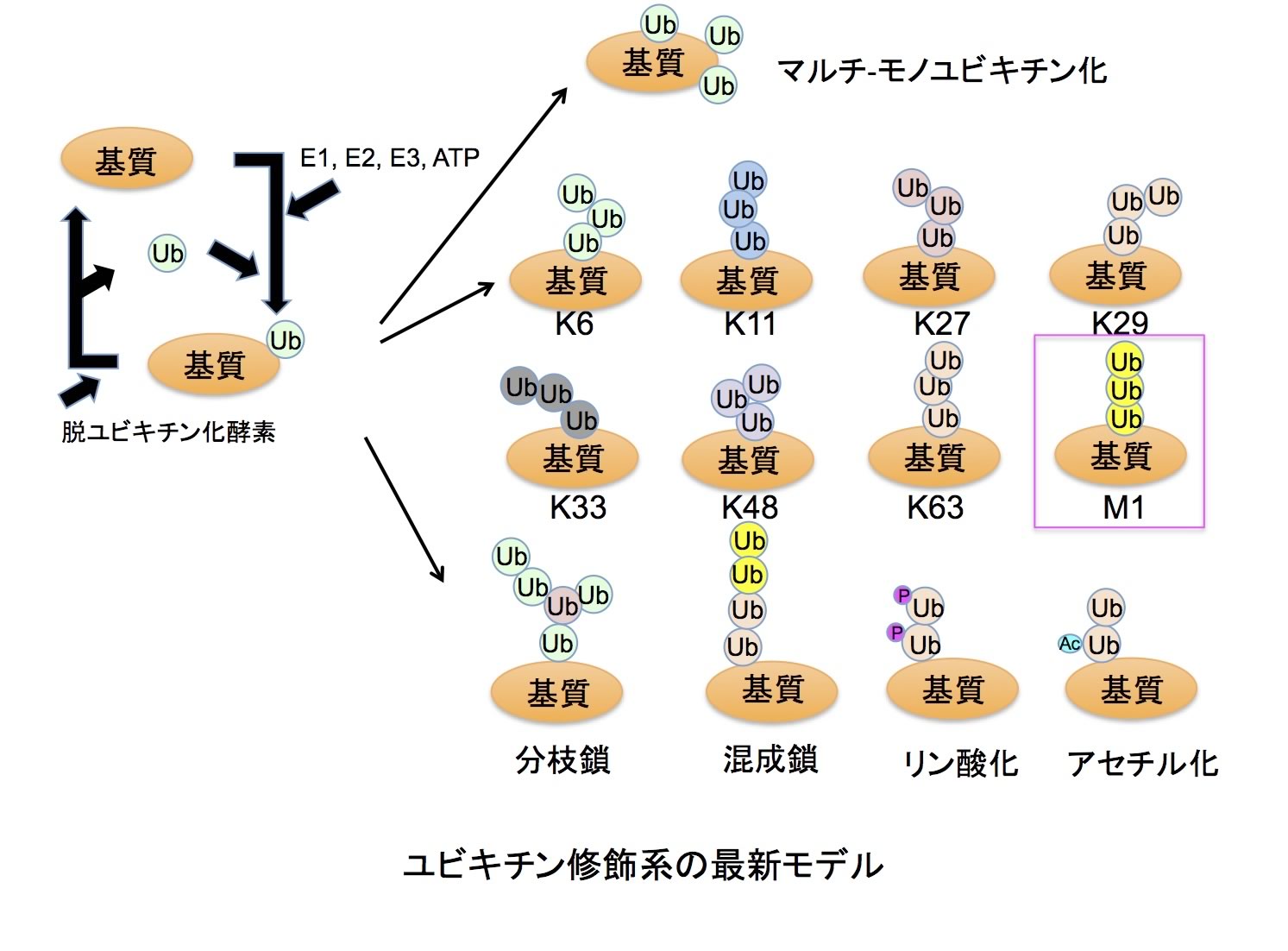
ユビキチン修飾系は、E1(ユビキチン活性化酵素)、E2(ユビキチン結合酵素)、E3(ユビキチンリガーゼ)の3種の酵素活性を介して、標的タンパク質のLys残基側鎖に8.6kDaの低分子量球状タンパク質であるユビキチンをイソペプチド結合的に付加する翻訳後修飾系です。ヒトには2種のE1、約50 種のE2、約600種のE3が存在し、E3がユビキチン化すべき標的タンパク質を時空間特異的に識別するという最も重要な役割を担っています。さらに、標的タンパク質に結合されたユビキチンは、約100種類存在する脱ユビキチン化酵素によって除去され再利用されます。タンパク質のユビキチン化は、1分子のユビキチンが結合するモノユビキチン化と、ユビキチン内Lys残基を介して多数のユビキチンが数珠状に連結するポリユビキチン化があります。ユビキチン内 には7つのLys残基(K6、K11、K27、K29、K33、K48、K63)があり、生体内では生成頻度の差はあるものの、これら全てのLysを介してポリユビキチン鎖が形成されていることが明らかになっています。これまでに、モノユビキチン化は、エンドサイトーシスやメンブレントラフィックなど細胞内輸送に関与すること、K48ポリユビキチン鎖はプロテアソームによるタンパク質分解を導くこと、K63ポリユビキチン鎖は主にシグナル伝達、DNA修復など非分解シグナルとして活用されていることが分かっています。また、私達が同定した全く新しい「直鎖状ポリユビキチン鎖」は、古典的NF-κB経路制御に関与します。さらに、ホモティピックなポリユビキチン鎖だけでなく、分岐鎖型や混成型ポリユビキチン鎖など複雑な構造をもつユビキチン鎖の存在や、ユビキチン内の特定残基がリン酸化やアセチル化など翻訳後修飾を受けていることも分かってきました。この様なユビキチン修飾の多様性が多彩な生理機能制御を可能にするといえます。
NF-κB経路
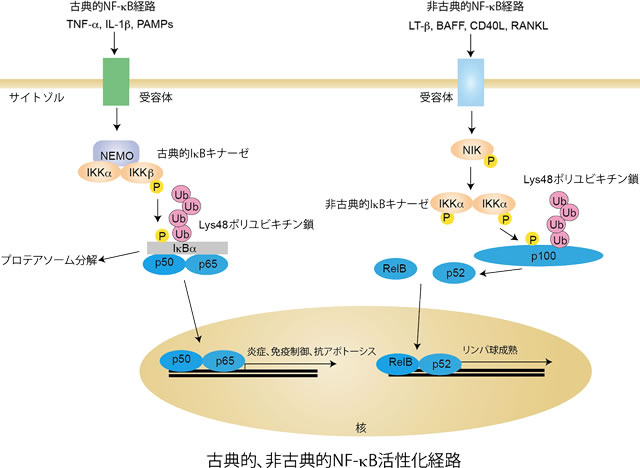
NF-κB(nuclear factor-κB)は、1986年にDavid Baltimoreらによって発見された5つのRelファミリータンパク質、すなわちp65 (RelA)、RelB、c-Rel、NF-κB1(p50/p105)、NF-κB2(p52/p100)のホモまたはヘテロ二量体からなる転写因子で、自然・獲得免疫、炎症、抗アポトーシス、リンパ球の成熟、細胞接着、骨形成などに関連する多数の遺伝子の調節を担っています。このためNF-κBは”免疫制御のマスタースイッチ”とも称され、実際にNF-κB経路の機能不全は癌、炎症性疾患(クローン病など)、自己免疫疾患(関節リウマチやSLEな ど)、生活習慣病(糖尿病など)の多くの病態を惹起することから、臨床や創薬標的としても高く注目されています。NF-κB活性化経路は古典的経路 (canonical pathway)と非古典的経路(non-canonical pathway)の2経路に大別されますが、いずれの経路においてもキナーゼによる連鎖的なタンパク質リン酸化のみならず、多様なユビキチン化修飾が重要な 調節役割を担っていることが明らかになってきました。古典的経路は炎症性サイトカイン(TNF-αやIL-1β)、病原体関連分子パターン(LPSなど)、ウイルスRNAやDNA、紫外線などの刺激によって、比較的迅速(数分)にIκBキナーゼ(IKK)α、IKKβ、NEMO(NF-κB essential modulator)からなる古典的経路のIKKが活性化し、主にp50とp65からなるNF-κB因子の核移行を引き起こすことで、炎症や免疫制御に関わる遺伝子群の発現を亢進させます。一方、非古典的経路はリンホトキシンβやCD40リガンドなどによって、比較的ゆっくりと(数時間)活性化されます。これらのリガンドで刺激を受けるとNIK(NF-κB inducing kinase)が安定化してIKKαの二量体からなる非古典的経路のIKKを活性化し、主にp52とRelBからなるNF-κBが核内へ移行してリンパ球成熟やリンパ器官の発達に関わる遺伝子の発現を亢進します。
I. 直鎖状ユビキチン化修飾を介した炎症・免疫シグナル制御と疾患の解明
NF-κBシグナルは炎症応答や自然・獲得免疫において中枢的な役割を果たすシグナル伝達経路です。当研究室では、ユビキチンのN末端Metを介してユビキチンが連結した「直鎖状ポリユビキチン鎖」を特異的に生成するユビキチンリガーゼ(LUBAC)を発見し、炎症性サイトカイン刺激時に伴うNF-κB経路活性化にLUBACが必須であることを見出してきました。そこで、CRISPR/Cas9法を用いたノックアウト技術を活用し、LUBACサブユニットの欠損細胞を作製し、生理機能への影響を解析しています。特に、自然・獲得免疫応答、MAPキナーゼ活性化経路、インターフェロン産生経路、アポトーシス経路、マイトファジーを中心に基礎研究を進め、その破綻によって引き起こされるB細胞リンパ腫、筋萎縮性側索硬化症(ALS)、パーキンソン病などの疾患との連関を明らかにします。
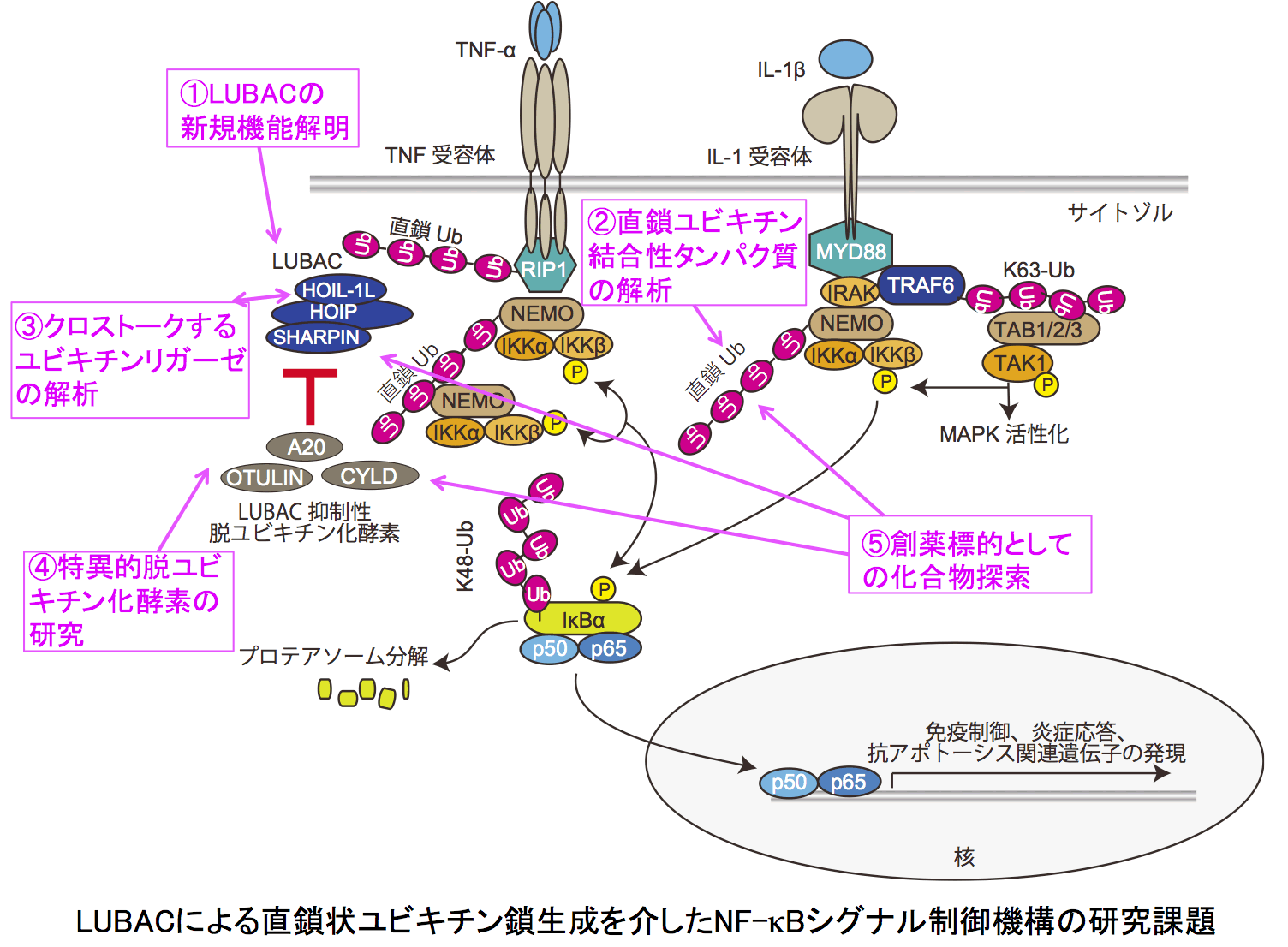
II. 新規NF-κBシグナル制御因子の同定と機能解析
LUBACが生成する直鎖状ユビキチン鎖は、特異的タンパク質を集積させる足場として働きます。したがって、直鎖状ユビキチン鎖結合タンパク質は、炎症・免疫シグナルの制御因子として機能する可能性があり、当研究室では新規直鎖状ユビキチン結合タンパク質の同定を進めるとともに、それらの細胞機能解析を行っています。また、LUBACに結合してその機能を増強または減弱させるユビキチンリガーゼを各1種同定しており、その細胞機能解析やノックアウトマウスを用いた研究から、ユビキチンリガーゼのクロストークが炎症・免疫を制御するという新たなパラダイムを拓きつつあります。
III. 脱ユビキチン化酵素の炎症・免疫制御やマイトファジーにおける役割
ヒトでは93種の脱ユビキチン化酵素が存在し、ユビキチンリガーゼによって生成されたユビキチン鎖を分解することで負の制御を司りますが、当研究室ではこれらの脱ユビキチン化酵素cDNAを独自に調整しており、炎症・免疫制御やミトコンドリア特異的オートファジー(マイトファジー)に関わる脱ユビキチン化酵素の同定を行っています。興味深いことに、脱ユビキチン化酵素の中には、ユビキチン分解のみならずユビキチン結合によって負の制御を司るものもあり、重要な機能ドメインの同定や抑制機構の構造生物学的解析を行っています。さらに、脱ユビキチン化酵素が関与する疾患との連関も視野に入れた研究を進めています。
IV. 創薬を目指したNF-κBシグナル制御性化合物の探索と生理機能解析
LUBACによる直鎖状ユビキチン鎖生成を介したNF-κB活性化は細胞の生存や各種疾患との連関も深いため、重要な創薬標的の一つです。当研究室では、LUBACのユビキチンリガーゼとしての活性阻害剤、直鎖状ユビキチン鎖とその結合タンパク質間の相互作用を抑制する化合物、及び直鎖状ユビキチン鎖制御に関わる脱ユビキチン化酵素の阻害剤のスクリーニングを創薬機構の化合物ライブラリーから検索し、有効なシード化合物を見出しています。現在、創薬への展開を目指して、これら化合物の生化学、細胞生物学、薬理学的作用機序の解明を進めています。
V. 分類不能型免疫不全症原因遺伝子の解析
分類不能型免疫不全症(Common Variable Immunodeficiency, CVID)は、複数サブクラスの抗体産生が不全になるため、易感染など免疫不全症を呈する難病であり、これまでに幾つかの原因遺伝子が同定されているものの、詳細な発症メカニズムは不明です。当研究室では、そのうちの1種について炎症・免疫応答、インターフェロン産生経路、アポトーシス、オートファジーとの関連を細胞レベルで解析するとともに、ノックアウトマウスの表現型解析を進めています。これによってCVIDの発症機構を解明し、新規創薬標的の同定を目指します。