お知らせ
新規LUBAC阻害剤(HOIPINs)の細胞レベルでの作用機序解明とB細胞リンパ腫や乾癬に対する治療効果を示した
ユビキチンのN末端を介した特殊な連結様式により形成される「直鎖状ユビキチン鎖」は、NF-κBなどの炎症シグナルや細胞死を制御するユニークかつ希少なユビキチンコードとして、近年、大きな注目を集めています。これまでに、直鎖状ユビキチン鎖を生成する唯一のユビキチンリガーゼとして、HOIL-1L、HOIP、SHARPINからなるLUBAC(linear ubiquitin chain assembly complex)複合体が同定されています。LUBACは、NF-κBシグナル経路の中心的酵素であるIκBキナーゼ(IKK)を制御するNEMOに直鎖状ユビキチン鎖を付加することで、古典的NF-κB 経路の活性化を導き、炎症・免疫制御に関わる遺伝子の発現を調節すること、また、その制御不全が皮膚炎やB細胞リンパ腫など、様々な疾患と関連することも知られています。
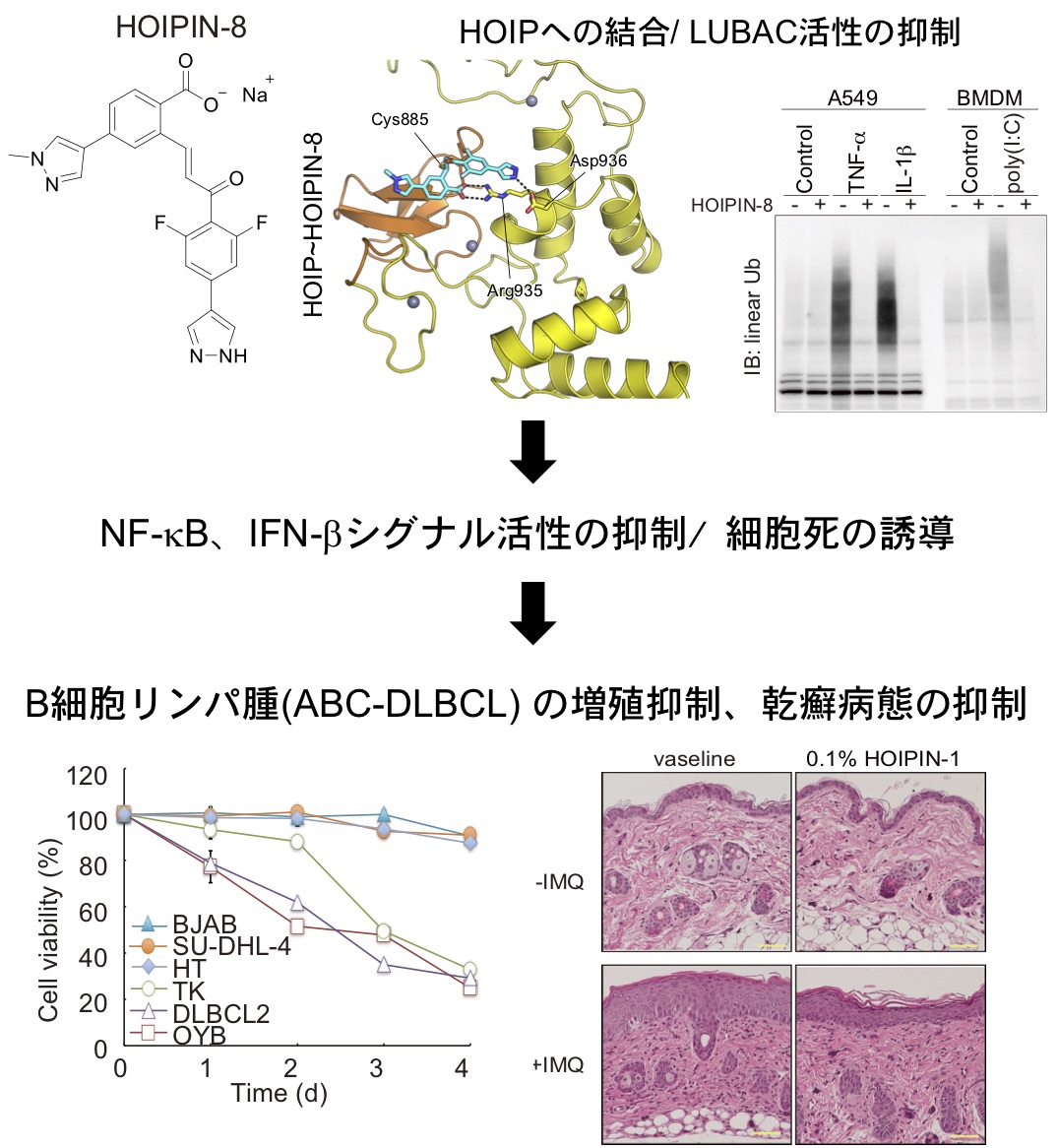
新規創薬ターゲットとしての可能性を背景に、我々は、LUBAC活性を阻害する新規化合物の探索を進めました。petit-LUBACという直鎖状ユビキチンを生成する最小構造ユニットを用いたHTRF法による探索系を構築し、25万個の化合物ライブラリーから、阻害活性を持つ候補化合物としてHOIP inhibitor-1(HOIPIN-1)と命名したsodium 2-[(1E)-3-(2-methoxyphenyl)-3-oxoprop-1-en-1yl] benzonateを発見しました(SLAS Discov. 2018)。次に、より強力な阻害活性を示す化合物を開発するため、HOIPIN-1をシード化合物として数十種類の誘導体を合成し、評価を進めました。その結果、HOIPIN-8と命名した化合物は、HOIPIN-1に比べて約255倍(IC50 = 11 nM)強くin vitroでの直鎖状ユビキチン鎖生成を阻害することを発見しました。HOIPIN-8は、細胞レベルにおいても、LUBAC発現に伴う細胞内直鎖状ユビキチン鎖量を低下させ、NF-κB活性化をIC50 = 0.42 μMで抑制しました。さらにTNF-αやIL-1βなど炎症性サイトカイン刺激に伴うNF-κB活性化や標的遺伝子発現を顕著に抑制するなど、既報のLUBAC阻害剤と比較しても、最も強力なLUBAC阻害剤であることを明らかにしました(BBRC. 2019)。
さらに我々は、HOIPIN-1及びHOIPIN-8がLUBACの活性中心であるHOIPサブユニットのCys885にマイケル反応により選択的に結合し、ユビキチン転移反応(RING-HECT-ハイブリッド反応)を抑制することを、結晶構造解析などから明確にしました。また、HOIPINsが、炎症性サイトカインのみならず、LPSやpoly I:Cなど各種病原体関連分子パターン(PAMPs)で惹起されるNF-κB活性化やインターフェロン産生経路の活性化を、LUBAC依存的に抑制すること、その際、HOIPINsはこれらの刺激による直鎖状ユビキチン鎖の産生のみを特異的に阻害し、K63型を含む他種のユビキチン鎖の動態には影響を与えないことを明らかにしました(Commun Biol. 2020)。
さらに、創薬シーズとしての検討も行い、HOIPINsが予後不良型の悪性リンパ腫でNF-κBの過剰活性化の関与が知られる活性化B細胞様びまん性大細胞型B細胞リンパ腫(ABC-DLBCL)に対して強力にアポトーシスを惹起させ、増殖を抑制することを見出しました。また、炎症性皮膚疾患である乾癬のマウスモデル(イミキモド添加モデル)において表皮の肥厚を有意に抑制し、病変組織における各種炎症性サイトカイン(IL-17、22、23)の誘導を抑制することも明らかにしました(Commun Biol. 2020)。
これらの結果から、HOIPINsが強力かつ特異性の高いLUBAC阻害剤であることが分かりました。今後は、他疾患に対する病態抑制効果についても検証を進めていく予定です。近年、神経変性疾患で認められるタンパク質凝集体形成に対する、直鎖状ユビキチン鎖の新たな寄与が近年報告されており(EMBO J. 2019)、我々のグループでも、複数の神経変性疾患において直鎖状ユビキチン鎖陽性の凝集体を見出しています(Nat Commun. 2016; Neurosci Lett. 2019; J Neuropathol Exp Neurol. 2020)。今後、その生理的意義の解明と新たな病態抑制手法の開発に向けて、HOIPINsを利用したアプローチを展開していきます。